Complicações pós-transplante de medula óssea
De forma didática, as complicações que acometem o paciente transplantado podem ser listadas em complicações decorrentes do regime de condicionamento, infecciosas, doenças do enxerto contra o hospedeiro aguda, doença do enxerto contra o hospedeiro crônica,complicações tardias, rejeição, recidiva da doença de base, etc. A seguir abordaremos cada uma delas em detalhe.
Vale a pena ressaltar que os primeiros 100 dias pós transplante apresentam mais complicações, e ao longo do TMO elas tendem a diminuir.
Toxicidades relacionadas ao regime de condicionamento
O regime de condicionamento precedente a infusão da medula óssea destrói as células que ocupavam o espaço intraósseo, mata a doença e imunossuprime o paciente para que ele possa aceitar a nova medula óssea, permitindo assim que haja condições para a nova medula nidar dentro dos ossos, se instalar e se desenvolver.
Infelizmente isto tem o custo de o paciente passar por alguns efeitos colaterais por período curto de 10 a 15 dias, relacionados aos fármacos empregados.
Em relação ao trato digestivo, o paciente pode apresentar sintomas como náuseas, vômitos, diarréia, mucosite. Sintomas estes tratados com antieméticos, protetores gástricos, hidratação, analgesia, e ajuste dietético. Com o tratamento os sintomas são minimizados e o paciente consegue tolerá-los.
Ocorre a pancitopenia, como descrito anteriormente, levando ‘a necessidade transfusional de hemoderivados.
A alopecia global reversível acontece na maioria dos casos, e pode ocorrer hiperpigmentação cutânea. Aproximadamente com dois meses pós TMO, a pele descama voltando a sua coloração normal e o cabelo e fâneros voltam a crescer.
Em relação ao sistema urinário, fármacos, tais como, a ciclofosfamida empregada em altas doses, pode causar hematúria franca, devido ao seu metabólito, a acroleína que apresenta ação vesicante. Esta complicação geralmente é tratada com esquemas de hiperhidratação, analgesia, e em alguns casos se faz necessário a sondagem uretral com sonda de tripla via para irrigação vesical, evitando assim que os coágulos formados obstruam o canal uretral. É necessário que a contagem plaquetária seja mantida em níveis ao redor de 50.000/ mm3 e o coagulograma seja vigiado amiúde. A hematúria pode durar de poucos dias a meses, dependendo do grau de lesão.
Continuando a abordagem do sistema urinário, em algumas situações clínicas onde o paciente é conduzido para o transplante em situações de refratariedade de doença e com grande quantidade de massas, durante a aplicação da quimioterapia em altas doses, pode ocrrer a síndrome de lise tumoral, que leva ‘a insuficiência renal por entupimento da via urinária por metabólitos provenientes da destruição tumoral. Para evitar esta complicação, quando o paciente apresenta muita doença , o mesmo já é mantido com hiperhidratação, alcalinização da urina com bicarbonato de sódio, e administração de alopurinol, além é claro da monitorização diária da funções renal e metabólica.
Diariamente são colhidos exames do paciente ao longo do TMO para análise diária dos metabólitos e funções hepática e renal, para a liberação das medicações ou ajuste das mesmas.
O fígado pode sofrer impacto relacionado a quimio em altas doses, com uma complicação conhecida por doença venoclusiva hepática ou mais recentemente renomeada de síndrome da obstrução sinusoidal. Trata-de de uma obliteração que ocorre nas vênulas hepáticas, que se traduz clinicamente por hepatomegalia dolorosa, retenção hídrica, plaquetopenia refratária, icterícia e ascite. Sua incidência pode variar de 8% nos TMO autólogos , até 21% nos alogênicos. O tratamento é feito com retenção de sódio, restrição de volume ofertado, manutenção das taxas plaquetárias acima de 30.000, hematócrito acima de 30% , nos casos mais graves é necessário a introdução da prostaglandinas e suporte dialítico. Esta complicação pode ter evolução fatal, por esta razão deve ser reconhecida e tratada precocemente.
Em relação ao sistema cardiovascular, a necessidade de hiperhidratar o paciente para que se evite complicações, não raramente leva ‘a sobrecarga cardíaca com elevação do peso e da pressão arterial e freqüentemente se faz necessário antihipertensivos e diuréticos. Algumas drogas, como a ciclofosfamida em alta dose pode causar lesão na fibra miocárdica, simulando ao eletrocardiograma, alterações no tamanho dos complexos QRS, supra ou infradesnivelamentos do segmento ST , e, por esta razão o ECG é feito rotineiramente.
Os pulmões podem sofrer impacto quando o condicionamento utiliza a radioterapia corporal total,e neste caso pode-se observar a ocorrência de pneumonite actínica, tratada com a aplicação de corticosteróides. Outra complicação que pode ocorrer eventualmente, é a fibrose pulmonar secundária a fármacos como o bussulfano e a radioterapia.
O bussulfano pode ocasionar crises convulsivas, quando utilizado em altas doses, por esta razão é rotineira a administação concomitante de fenitoína. A ciclosporina, o imipenen, e a hipomagnesemia também podem causar convulsões, sendo necessário a intervenção madicamentosa com anticonvulsivantes. Fármacos como a metoclopromida podem levar ‘a síndrome de liberação extra-piramidal sendo necessário sua suspensão.
Infecções no TMO
É relativamente freqüente a ocorrência de complicações infecciosas ao longo do transplante de medula óssea e cabe ao transplantador identificá-las e tratá-las precocemente.
Nas últimas décadas a abordadem diagnóstica e terapêutica das infecções melhorou sobremaneira, de tal sorte que a sobrevida melhorou acentuadamente, tornando o TMO um tratamento relativamente seguro.
São muitas as razões que levam o paciente transplantado a ter mais infecções, e nas próximas linhas enumeraremos algumas delas.
Logo que o paciente é admitido para o programa de TMO, um cateter venoso central de longa permanência é implantado, com o objetivo de se administrar todas as medicações, quimioterápicos em altas doses, transfusões, além da medula óssea e da coleta de exames de sangue diários, poupando assim o paciente das múltiplas punções venosas diárias. Pode ocorrer complicações com este cateter de ordem infecciosa como a infecção do túnel e do orifício de saída por agentes Gram positivos, ou infeccção primária da corrente sanguínea por bactérias Gram positivas, negativas, e fungos.
A aplicação da quimioterapia em altas doses como citado anteriormente neste capítulo, conduz o paciente a um período de aplasia prolongada, 2 a 3 semanas, e a conseqüência é a chance de infecções por bactérias Gram positivas, negativas, fungos, oportunistas, virais, etc. O amplo conhecimento deste momento e ter em mente a busca contínua da infecção e do agente, permite debelar o problema com agilidade e efetividade.Nesta fase o paciente rotineiramente recebe a aplicação de antibióticos e antifúngicos e antivirais profiláticos. É comum nesta etapa a ocorrência da febre de origem indeterminada e a ampliação ostensiva de antibióticos é feita com o objetivo de resolver a infecção.
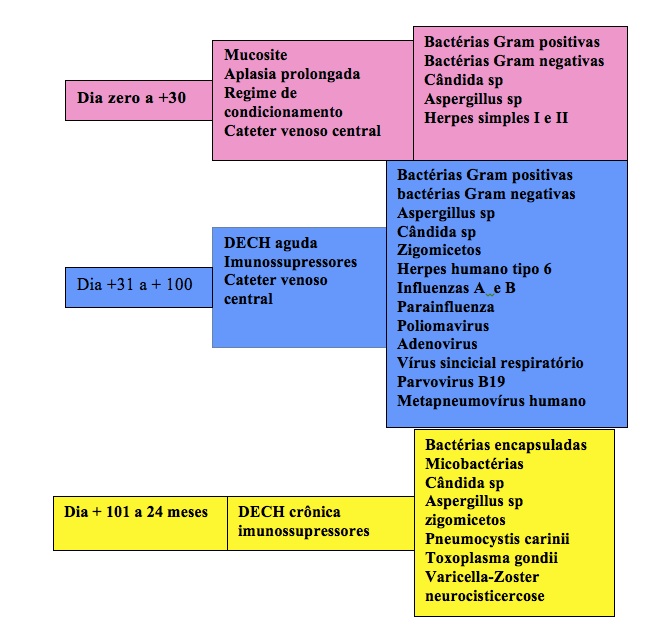
Com a “pega” medular, o paciente eleva as taxas de leucócitos, mas ainda continua imunossuprimido devido as drogas imunossupressoras utilizadas no tratamento da doença do enxerto contra o hospedeiro, tais como a ciclosporina, metotrexate, corticosteróides, etc .Também, porque a imunidade humoral, célular e do sistema reticuloendotelial só estará completada ao final do segundo ano do TMO alogênico e de seis meses do autólogo. Os agentes que infectam os pacientes nesta fase podem ser bactérias Gram positivas, negativas, fungos, Citomegalovirus poliomavirus, vírus sincicia respiratório, Influenzas A e B, Herpes Humano tipo 6 , agentes oportunistas ( Isospora belli, Criptosporidium sp), protozoários, micobactérias , etc. Novamente cabe a experiência do transplantador em reconhecer e tratar precocemente.
Após os 100 dias de transplante, o índice de infecção sofre um declínio, pois em geral, a medula óssea já está em pleno funcionamento recuperando o número e a função dos neutrófilos, os linfócitos já esboçam certa funcionalidade, o paciente já cicatrizou as lesões da mucosa ( mucosite), não está vindo mais diariamente ao hospital e portanto não sofre tanta colonização e mudança da flora intestinal, já está se alimentando melhor e o organismo está com mais dinamismo. Apesar deste declínio, as infecções ainda acometem o paciente e permanece a orientação de vir ao hospital na presença de um pico febril, ou se observar calafrios, diarréia, vômitos, etc.
Após os 100 dias , o paciente ainda é classificado como imunossuprimido, apesar da redução do índice de infecção, pois ainda está sob medicações para o tratamento da doença do enxerto contra o hospedeiro crônica no alogênico, quais sejam, micofenolato mofetil, ciclosporina, corticosteróides, tacrolimus, e nos casos dos autólogos , por vezes, estão recebendo interferon, rituximab, ou radioterapia de consolidação pós transplante.
Os agentes que acometem o transplantado mais tardiamente , em geral , são as bactérias encapsuladas , micobactérias, Toxoplasma gondii, Pneumocystis carinii , Varicela-Zoster.
Para concluir, vale dizer que, os tipos e a severidade das infecções diferem de acordo com o tipo de transplante, o grau de histocompatibilidade entre o doador e o receptor, a imunoprofilaxia utilizada para a doença do enxerto contra o hospedeiro, a idade do paciente, o regime de condicionamento, a situação da doença de base, o índice de Karnofsky do paciente, antecedentes infecciosos, e outras comorbidades clínicas associadas.
A tabela II resume os agentes infecciosos em relação as fases do TMO.
Quando o paciente completa um ano de transplante ele é submetido a um esquema completo de vacinação, como se fosse uma criança, pois ao longo do TMO ele perdeu a memória imunológica das vacinas.
Tabela II – Agentes infecciosos no TMO conforme o tempo pós transplante e os fatores de risco
Doença do enxerto contra o hospedeiro (DECH)
A doença do enxerto contra o hospedeiro (DECH), é uma condição peculiar ao transplante alogênico. Os linfócitos do doador imunocompetente, não reconhecem as células do receptor (o corpo do receptor) como próprias e atacam o receptor em três principais órgãos –alvo, a pele, o tubo digestivo e o fígado.
Ainda, os linfócitos do doador imunocompetentes da mesma forma que não recenhecem as células do receptor como próprias, também não reconhecem a doença tumoral do paciente ( leucemia, linfoma,etc) e acaba por destruir as células tumorais e funcionar como um vigilante crônico dentro do paciente destruindo novas células tumorais que surjam – este fenômeno é conhecido como efeito do enxerto contra a leucemiaou contra a doença oncohematológica..
Todos os pacientes recebem rotineiramente imunoprofilaxia para a DECH desde o dia anterior ‘a infusão da medula óssea , e ao longo de alguns meses do pós TMO. O objetivo da imunoprofilaxia é impedir que o paciente venha a apresentar graus intensos de DECH, correndo risco de vida. A imunoprofilaxia é composta classicamente por ciclosporina e metotrexate, mas pode ser modificada para mais ou para menos, segundo o tipo de transplante a que o paciente está sendo submetido. Outras medicações que podem ser utilizadas para a imunoprofilaxia são a timoglobulina de coelho, o micofenolato mofetil, o tacrolimus, corticosteróides, e até a depleção medular in vitro das células T do doador.
Quando a DECH ocorre até os cem primeiros dias do tmo , ela recebe o nome de DECH aguda, quando ocorre após os cem primeiros dias, recebe o nome de crônica.
Conforme a graduação com a qual os linfócitos do doador agridem cada um dos órgãos-alvo, é montado um estadiamento clínico da intensidade da doença do enxerto contra o hospedeiro, com ilustra a tabela III.
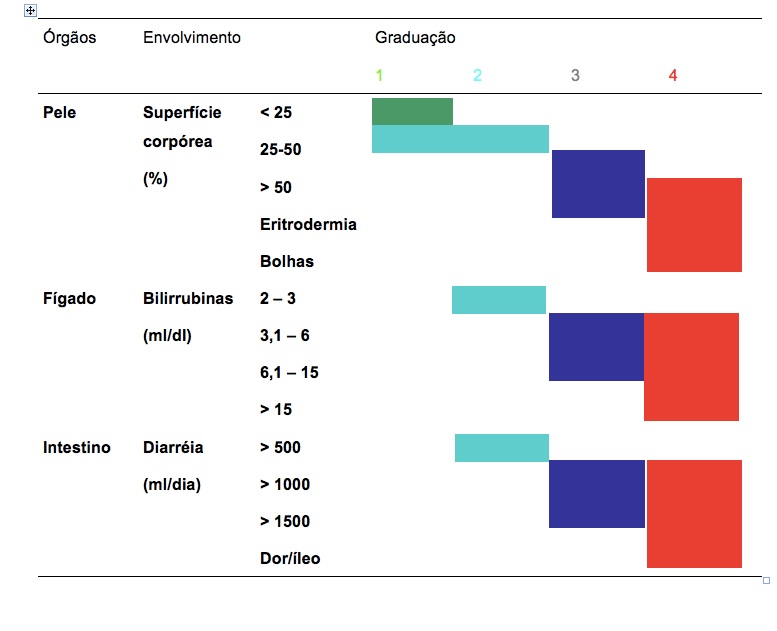
A graduação da DECH pode variar de ausente, grau I (leve), grau II (moderada), grau III ( grave), até grau IV( muito grave).
No grau I (leve) – apenas a pele torna-se levemente hiperemiada, e esta hiperemia acomete menos de 25% da superfície corporal.
No grau II (moderada) – a hiperemia cutânea acomete entre 25 a 50% da superfície corporal, as taxas de bilirrubinas no sangue podem se elevar para 2 a 3 mg/dl e o volume diarrêico ser ao redor de 500ml e menos de 1000ml em 24 horas.
No grau III ( grave) – a hiperemia cutânea pode acometer desde 50% da pele até ser uma eritrodermia generalizada, as taxas de bilirrubinas séricas oscilam entre 3 a 15 mg/dl e o volume diarréico variar em 24 horas entre 1000ml a mais de 1500ml.
No grau IV ( muito grave) – a hiperemia cutânea pode ir desde 50% da superficie cutânea até a eritrodermia generalizada, formação de bolhas, exsudação extrema e perda do tecido.. As taxas de bilirrubinas séricas podem variar de 3 a níveis maiores do que 15mg/dl e o volume diarréico ir de mais de 1000ml, até mais de 1500ml, íleo-paralítico, diarréia sanguinolenta com dor abdominal intensa.
A maioria dos pacientes recebem rotineiramente imunoprofilaxia para a DECH, contudo, apesar da prevenção uma parte dos pacientes desenvolverão esta doença, e necessitarão de tratamento.
As DECH classificadas como ausente e grau I não requerem tratamento adicional, além daquele que compõe a imunoprofilaxia.
Já nas DECH graus II, III, e IV, é imperativo que medidas adicionais terapêuticas sejam adotadas. Tais medidas incluem a adição de corticostéróides e/ou micofenolato mofetil e/ou talidomida e/ou tacrolimus e/ou azatioprina e/ou timoglobulina.
É fácil compreender que o controle da DECH aguda recebe a adição de mais imunossupressão para que os linfócitos do doador deixem de atacar o receptor, mas este acréscimo deixa o paciente com seu sistema imune bem bloqueado, facilitando assim o surgimento de infecções.
Tabela III – Graduação clínica da doença do enxerto contra o hospedeiro aguda
Doença do enxerto contra o hospedeiro crônica
A DECH crônica acomete o paciente após os 100 dias de transplante, e diferentemente da DECH aguda, se assemelha ‘as doenças auto-imunes do colágeno, em especial a esclerodermia sistêmica, síndrome de Sjögren, cirrose biliar primária, síndrome sicca, citopenias imunes, bronquiolite obliterante e a imunodeficiência crônica. Sua incidência pode variar de 6 a 50% , baseado no tipo de doador , idade do paciente, fonte de células, manipulação do enxerto(depleção de células T), ou infusão de linfócitos do doador, e do grau de histocompatibilidade.
Ela pode acontecer como uma extensão da DECH aguda ( DECH crônica progressiva), após um intervalo sem nenhuma DECH ( quiescente), ou surgir em um paciente que nunca apresentou DECH (de novo).
Sua graduação pode ser limitada ou extensa ( Tabela IV). A forma limitada acomete a pele de forma localizada e podemos observar elevação discreta das enzimas hepáticas principalmente canaliculares. O grau limitado raramente requer tratamento.
A forma extensa descrita na tabela IV requer tratamento para o seu controle e este tratamento se baseia na adição de fármacos imunossupressores isoladamente ou em combinação.
Tabela IV – Graduação da DECH crônica

A pele é o órgão mais freqüentemente acometido com lesões que vão desde pápulas liquenóides, áreas de eritema focal, hiper ou hipopigmentação, até formas extensas graves, nos quais a pele torna-se difusamente espessada, fibrótica, dando origem ‘as contraturas e limitações de movimento.
O envolvimento do trato gastrintestinal é freqüente, na cavidade oral podem surgir líquen plano, estrias, placas, atrofia, eritema da mucosa oral, jugal e língua. Em formas mais graves, o tubo digestivo pode sofrer fibrosamento, tornando-se rígido, sem haustrações, acarretando síndromes disabsortivas.
Uma outra complicação comum da DECH crônica é a síndrome sicca que pode acometer os olhos, cavidade oral, vagina e produção espermática. Há por vezes, necessidade de lágrimas e salivas artificiais, além de lubrificantes vaginais.
O pulmão é outro órgão que pode ser envolvido, na forma de bronquiolite obliterante ou bronquiolite obliterante com pneumonia em organização. O quadro repercute em obstrução da saída do ar pelos pulmões e o quadro clínico assemelha-se a de um asmático, com sibilância, estertorações, chiados, dispnéia. Além do tratamento imunossupressor, são combinados broncodilatadores, e muitas vezes antimicrobianos e fisioterapia respiratória.
A DECH crônica causa retardo na recuperação imunológica, com alteração dos níveis de imunoglobulinas, disfunção das citocinas, prejuízo da opsonização, retardo na migração dos granulócitos, propiciando desta forma, o aumento nos índices de infecção.
A DECH crônica é geralmente tratada com sucesso, com fármacos imunossupressores combinados, que permitem ao paciente boa qualidade de vida, integração social e retorno ao trabalho.
Vale a pena salientar que a DECH crônica tem papel crucial na sustentação da remissão completa do paciente com doença oncohematológica, pois os linfócitos do doador protegem o paciente não reconhecendo o clone tumoral com “ self ”. Portanto, o transplante alogênico sustenta a remissão e cura do doente utilizando a imunologia a seu favor também, além de tudo o que foi exposto.
Recentemente em trabalho publicado em 2005/2006, um grupo de transplantadores dos EUA, em especial do Fred Hutchinton Cancer Research Center – em Seattle, se reuniram, para tentar criar um sistema de “score” que denote a extensão e a severidade da DECH crônica, definina DECH crônica mínima e determine melhor o tratamento tópico ou sistêmico, e traduza a realidade clínica do paciente e suas limitações, contraturas,etc.
Estas recomendações ainda aguardam validação prospectiva, mas podem ser sumarizadas em três itens:
a) diferenciação da DECH aguda;
b) presença de pelo menos um diagnóstico/sinal clínico de DECH crônica ou presença de pelo menos uma manifestação documentada por biópsia ou exame de pesquisa específico( histológico, radiológico, funcional);
c) exclusão de outro diagnóstico possível.
Cada órgão avaliado recebe avaliação do envolvimento, se ausente, leve, moderado e severo ( “score” 0, 1,2 e 3).
A soma dos pontos de cada órgão classificará o paciente em DECH crônica leve, moderada e grave.
DECH leve foi definida como envolvendo 1 ou 2 órgãos, exceto pulmão, com “score” máximo de 1 dado para cada órgão.
DECH moderada – pelo menos um órgão ou sítio com “score” de 2 ou 3 ou mais órgãos acometidos com “score” de 1.
DECH severa – “score 3” em qualquer órgão ou sítio – indicando disabilidade maior.
Para os pulmões a classificação “score” 1 é traduzida como moderada e para “score” 2 como DECH severa.
Para as formas moderadas e severas a imunossupressão sistêmica deve ser considerada. Os órgãos a serem avaliados são: pele, unhas, cabelo e fâneros, boca, olhos, genitália, trato digestivo,fígado, pulmão, sistema osteoarticular e muscular, sistema hematopoético e imune, e outros( neuropatia periférica, síndrome nefrótica, miastenia gravis, condução cardíaca anômala ou cardiomiopatia, derrames pleurais, autoanticorpos).
Recidiva da doença de base
A recidiva da doença que motivou o transplante, pode ocorrer tanto no TMO alogênico, quanto no autólogo, sendo que neste último a incidência é maior.
Quando o paciente recai após o transplante autólogo, algumas alternativas são conduzi-lo para um transplante com doador aparentado ou não aparentado, ou reiniciar tratamento quimioterápico e depois submetê-lo a novo transplante autólogo, ou ainda manter o paciente com tratamento da doença de base sem nenhum tipo de tmo. A decisão de qual opção ser escolhida passa pela vontade do paciente e de seus familiares, a presença de um doador disponível ou não, a idade e performance status do paciente, a situação oncológica da recaída, e análise médica criteriosa.
A incidência de recaída no transplante alogênico é menor em relação ao autólogo, graças ao efeito do enxerto contra a doença. E é justamente neste efeito que atuaremos no caso da recaída do paciente pós tmo. A primeira opção é a imediata suspensão das drogas imunossupressoras, objetivando o aumento da DECH e portanto o combate a leucemia, linfoma, etc. O paciente terá seu quadro clínico modificado e é monitorado de perto quanto a intensidade e necessidade de retorno das medicações , no caso da DECH se tornar grave.
Naqueles paciente mais tardios de transplante , que não estavam mais fazendo uso de imunossupressão, a técnica acima não tem fundamento, para este caso, lança-se mão da infusão de linfócitos retirados do doador e infundidos a fresco no paciente, ofertando assim os mesmos linfócitos que no começo do TMO causaram a DECH. Com isto o paciente desenvolve quadro clínico de DECH capaz de livrá-lo da doença .
Se nenhuma das anteriores surtiram efeito, o paciente poderá ser submetido a outro transplante alogênico do mesmo doador ou de outro se existir esta opção.
Rejeição no TMO
A rejeição pode acontecer em pacientes que submetidos ao transplante de medula óssea para doenças como anemia aplástica grave, anemia de Fanconi, anemia de Blackfan-Diamond. Se caracteriza pela perda do enxerto.
Ela pode receber a classificação de precoce, quando ocorre logo após o transplante e o paciente não apresenta enxertia ou se apresentou esta o faz de forma frustra e transitória e rapidamente desaparece. E é classificada como tardia, quando acontece após 90 dias de transplante.
O tratamento da rejeição varia desde o aumento na imunossupressão até a administração de fármacos complementares com a timoglobulina de coelho, chegando até a necessidade de novo transplante
Os fatores que corroboram para o aumento da rejeição são o número de transfusões de hemoderivados pré tmo, e a presença de quimerismo misto pós tmo.
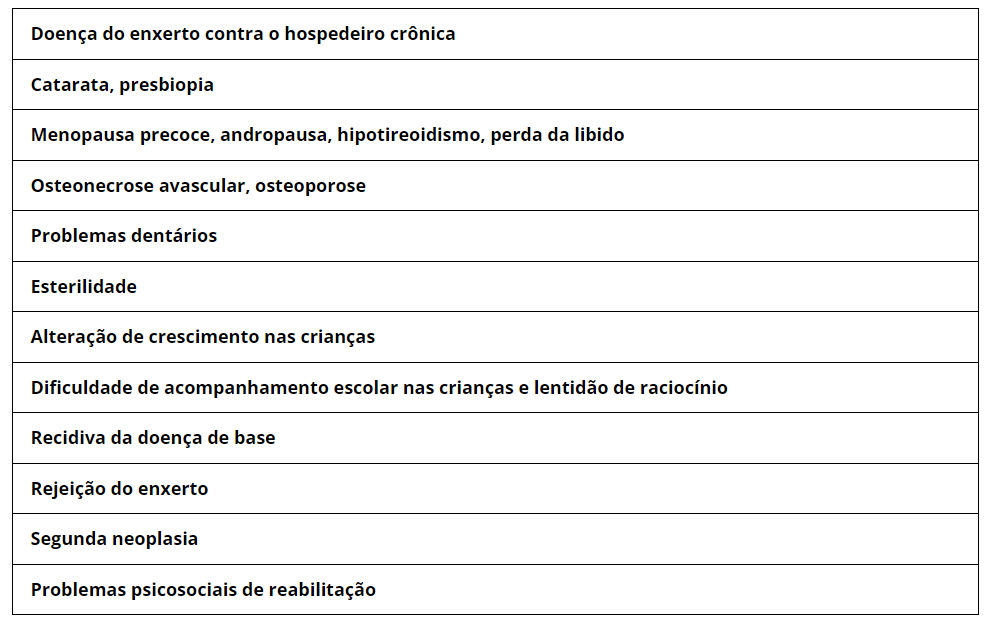
Complicações tardias pós TMO
Conforme o número de transplantes cresceu em todo o mundo, e os resultados promissores vieram, um número crescente de sobreviventes alcançaram uma vida feliz e produtiva, porém também começaram a ser conhecidas as complicações tardias relacionadas ao tratamento.
Vários são os fatores que contribuem para as complicações pós TMO, quais sejam, o regime de condicionamento, a idade do paciente, o tipo de TMO, fármacos empregados no tratamento da DECH aguda e crônica, comorbidades, doença de base que indicou o transplante, complicações infecciosas graves no curso do tmo e etc.
Podemos citar com algumas complicações, a necrose da cabeça do fêmur e a catarata decorrentes do uso de corticosteróides. Esterilidade secundária ao regime de condicionamento, distúrbios endócrinos como menopausa precoce, hipotireoidismo, andropausa relacionados ao uso do condicionamento e da radioterapia , etc. As complicações encontram-se sumarizadas na tabela V.
Tabela V – Complicações tardias relacionadas ao TMO